Kata
Pengantar
Dengan
menyebut nama Allah SWT yang Maha Pengasih lagi Maha Panyayang, kami panjatkan
puja dan puji syukur atas kehadirat-Nya, yang telah melimpahkan rahmat,
hidayah, dan inayah-Nya kepada kami, sehingga kami dapat menyelesaikan laporan
pembuatan termos sederhana dengan baik.
Adapun
laporan pembuatan termos sederhana ini telah kami usahakan semaksimal mungkin
dan tentunya dengan bantuan berbagai pihak, sehingga dapat memperlancar
pembuatan laporan ini. Untuk itu kami tidak lupa menyampaikan bayak terima kasih
kepada semua pihak yang telah membantu kami dalam pembuatan laporan ini.
Namun
tidak lepas dari semua itu, kami menyadar sepenuhnya bahwa ada kekurangan baik
dari segi penyusun bahasanya maupun segi lainnya. Oleh karena itu dengan lapang
dada dan tangan terbuka kami membuka selebar-lebarnya bagi pembaca yang ingin
memberi saran dan kritik kepada kami sehingga kami dapat memperbaiki laporan
ini.
Akhirnya
penyusun mengharapkan semoga dari laporan pembuatan termos sederhana ini dapat
diambil hikmah dan manfaatnya sehingga dapat memberikan inpirasi terhadap
pembaca.
Jakarta,15 November 2017
Penyusun
1. Dasar
Teori
Pengertian Termodinamika Termodinamika
merupakan ilmu yang mempelajari hubungan antara usaha dan kalor. Di dalam
termodinamika kita mengenal adanya sistem dan lingkungan. Dalam termodinamika
sistem diarttikan sebagai kumpulan dari benda – benda atau objek yang diteliti
atau menjadi pusat perhatian kita sedangkan lingkungan diartikan sebagai benda
atau objek yang berada di luar sistem. Batas ialah perantara antara siitem dan
lingkungan. Daerah tempat Sistem dan lingkungan berada disebut semesta.
Hukum I termodinamika menyatakan bahwa
"Jumlah kalor pada suatu sistem adalah sama dengan perubahan energi di
dalam sistem tersebut ditambah dengan usaha yang dilakukan oleh sistem."
Hubungan antara kalor dan lingkungan dalam hukum I Termodinamika seperti yang ditunjukkan pada gambar 1.
Energi dalam sistem adalah jumlah total semua energi molekul yang ada di dalam sistem. Apabila sistem melakukan usaha atau sistem memperoleh kalor dari lingkungan, maka energi dalam sistem akan naik. Sebaliknya energi dalam sistem akan berkurang jika sistem melakukan usaha terhadap lingkungan atau sistem memberi kalor pada lingkungan. Dengan demikian dapat disimpulkan bahwa perubahan energi dalam pada sistem tertutup merupakan selisih kalor yang diterima dengan usaha yang dilakukan sistem.
Rumus Hukum I Termodinamika
Dari bunyi hukum I Termodinamika, maka rumus hukum I Termodinamika dapat dituliskan sebagai berikut :
Q = ∆U + W atau ∆U = Q – W atau
Dimana :
∆U : Perubahan energi dalam sistem (J)
Q : Kalor yang diterima/dilepas sistem (J)
W : Usaha (J)
Hubungan antara kalor dan lingkungan dalam hukum I Termodinamika seperti yang ditunjukkan pada gambar 1.
Energi dalam sistem adalah jumlah total semua energi molekul yang ada di dalam sistem. Apabila sistem melakukan usaha atau sistem memperoleh kalor dari lingkungan, maka energi dalam sistem akan naik. Sebaliknya energi dalam sistem akan berkurang jika sistem melakukan usaha terhadap lingkungan atau sistem memberi kalor pada lingkungan. Dengan demikian dapat disimpulkan bahwa perubahan energi dalam pada sistem tertutup merupakan selisih kalor yang diterima dengan usaha yang dilakukan sistem.
Rumus Hukum I Termodinamika
Dari bunyi hukum I Termodinamika, maka rumus hukum I Termodinamika dapat dituliskan sebagai berikut :
Q = ∆U + W atau ∆U = Q – W atau
Dimana :
∆U : Perubahan energi dalam sistem (J)
Q : Kalor yang diterima/dilepas sistem (J)
W : Usaha (J)
Perjanjian pada hukum I Termodinamika
Rumus hukum I Termodinamika digunakan dengan perjanjian sebagai berikut :
1. Usaha (W) bernilai positif (+) jika sistem melakukan usaha
2. Usaha (W) bernilai negatif (-) jika sistem menerima usaha
3. Q bernilai negatif jika sistem melepas kalor
4. Q bernilai positif jika sistem menerima kalor
Rumus hukum I Termodinamika digunakan dengan perjanjian sebagai berikut :
1. Usaha (W) bernilai positif (+) jika sistem melakukan usaha
2. Usaha (W) bernilai negatif (-) jika sistem menerima usaha
3. Q bernilai negatif jika sistem melepas kalor
4. Q bernilai positif jika sistem menerima kalor
2. Rumusan
Masalah
1. Bagaimana cara
pembuatan termos sederhana?
2. Bagaimana termos
sederhna dapat menjelaskan dalam penerapan termodinamika?
3. Apa saja
aplikasi termos sederhana dalam kehidupan sehari-hari ?
3. Tujuan
1. Mengetahui
cara pembuatan dan cara kerja termos sederhana.
2. Menyebutkan
aplikasi atau penerapan termos sederhana dalam kehidupan sehari-hari.
3. Untuk
mengetahui teantang hukum 1 termodinamika.
4.
Untuk mengetahui penerapan hkum 1 termodinamika pada termos air panas.
4. Alat
dan Bahan
1. Botol plastik ukuran 1 liter
2. Botol kaca sirup
3. Isolasi besar
4. Isolasi kecil
5. Cutter
6. Gunting
7. Alumunium foil
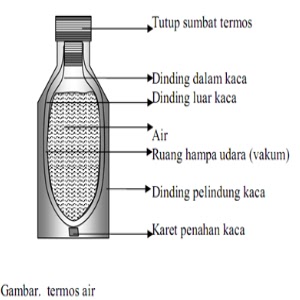
5. Cara
Kerja
1. Gulung botol kaca dengan kertas
alumunium foil seluruh nya
2. Lalu rekatkan dengan isolasi
3. Setelah itu gulung kembali botol
kaca dengan kertas alumunium foil
4. Dan rekatkan kembali dengan
isolasi
5. Lalu ambil botol plastik dan
potong bagian leher botol
6. Setelah bagian leher botol
tersebut dipotong, kemudian potong garis bawah dari leher botol
7. Setelah itu masukkan botol kaca ke
botol plastik
8. Dan satukan kembali botol plastik
yang sudah dipotong potong menggunakan isolasi
9. Termos sederhana dari botol bekas
selesai
6. Pembahasan
Termos menggunakan bahan yang bersifat adiabatik.
Bahan adiabatim secara ideal menghambat atau tidak memungkinkan adanya
interaksi, antara sistem dengan lingkungan, tidak ada perpindahan kalor antara
sistem dalam termos dan lingkungannya. akibat nya tidak terjadi pertukaran
temperatur. dengan menggunakan bahan adiabatik ini termos mampu mempertahankan
suhu air yang berada di dalamnya. dan suhu air tidak terkontaminasi dengan suhu
lingkungannya.
Prinsip
kerjanya termos air adalah sebagai isolator atau pencegah berpindahnya panas
dari air ke udara luar. Karena tekanan udara luar untuk daerah tinggi memang
lebih rendah dibandingkan daerah yang datarannya rendah, sehingga molekul air
lebih mudah terlepas ke udara menjadi uap (mendidih). Waktu memasak air didataran
tinggi air akan lebih mudah mendidih, karena titik didih zat cair dipengaruhi
oleh tekanan udara diatas permukaan zat cair. Semakin kecil tekanan udara
diatas permukaan zat cair, maka semakin rendah titik didih zat cair tersebut di
daerah dataran tinggi atau pemgunungan, tekanan udaranya lebih kecil
dibandingkan tekanan udara di dataran rendah, sehingga titik didih didataran
tinggi atau pegunungan lebih rendah dari daerah dataran tinggi. Karena titik
didih di dataran tinggi lebih rendah maka air akan cepat mendidih.
7. Kesimpulan
Dari pembahasan diatas, kami dapat menarik kesimpulan
sebagai berikut :
1.
Termodinamika adalah cabang ilmu fisika yang
mempelajari tentang suhu, kalor, dan besaran mikroskopis lainnya.
2.
Hukum 1 termodinamika membahas tentang kekekalan
energi, dan juga membahas tentang sistem dan lingkungan. Pada hukum 1 termodinamika terdapat proses isobarik,
isotermal, dab adiabatik.
3.
Contoh penerapan hukum 1 termodinamika yaitu
pada termos air panas. Pada termos terjadi proses adiabatik yaitu proses yang
tidak memungkinkan kalor untuk keluar masuk sistem (Q=0). Oleh karena itu,
usaha yang dilakukan gas sama dengan perubahan energi didalamnya (W= ∆U) , sehingga tidak memungkinkan terjadinya
interaksi, antara sistem dan lingkungan, serta tidak ada perpindahan kalor
antara sistem dalam termos yaitu air panas dengan lingkungannya.
DAFTAR PUSTAKA
Komentar
Posting Komentar